合作客戶/
拜耳公司 |
同濟(jì)大學(xué) |
聯(lián)合大學(xué) |
美國保潔 |
美國強生 |
瑞士羅氏 |
相關(guān)新聞Info
-
> 應(yīng)用熒光顯微鏡研究了蛋白質(zhì)在氣-水界面的組裝——摘要、介紹
> 篩選常用、經(jīng)濟(jì)且可抑制低階煤煤塵的表面活性劑(一)
> 誘導(dǎo)期測定法研究NaCl的添加對碳酸鋰固-液界面張力等成核動力學(xué)參數(shù)影響——過飽和度的計算
> 低界面張力納米流體提高低滲透油藏壓裂滲吸速率和采收率(一)
> 拉筒法和靜滴法測定連鑄結(jié)晶器保護(hù)渣表面張力(一)
> 水面上單分子層膜通過磷脂光控開關(guān)實現(xiàn)可逆光學(xué)控制——結(jié)論、致謝!
> 表面活性劑對煤塵潤濕效果的定量化研究
> 毛細(xì)現(xiàn)象:表面張力和接觸角兩者有什么關(guān)系?
> 探究LB復(fù)合膜的酸致變色特性
> 鋰電池隔膜粘接劑組合物稀釋液表面張力測試及影響
推薦新聞Info
-
> 釕催化劑合成丁炔二醇醚三硅氧烷表面活性劑反應(yīng)條件及表面張力測定(三)
> 釕催化劑合成丁炔二醇醚三硅氧烷表面活性劑反應(yīng)條件及表面張力測定(二)
> 釕催化劑合成丁炔二醇醚三硅氧烷表面活性劑反應(yīng)條件及表面張力測定(一)
> 座滴法測量玻璃熔體表面張力準(zhǔn)確性及影響因素
> 座滴法測量玻璃熔體表面張力裝置、步驟
> 液體表面張力受力分析圖:原理、數(shù)學(xué)模型、應(yīng)用與實例
> 各向異性表面張力條件下定向凝固共晶生長形態(tài)穩(wěn)定性(下)
> 各向異性表面張力條件下定向凝固共晶生長形態(tài)穩(wěn)定性(上)
> NaOL、HZ組合捕收劑對鋰輝石礦物浮選效果、表面張力影響(三)
> NaOL、HZ組合捕收劑對鋰輝石礦物浮選效果、表面張力影響(二)
內(nèi)壓力是什么意思?液體表面張力與內(nèi)壓力的區(qū)別與定量關(guān)系
來源:大學(xué)化學(xué) 瀏覽 718 次 發(fā)布時間:2024-10-15
建立了液體表面張力與內(nèi)壓力間的定量關(guān)系,并據(jù)此得到了液體表面層的厚度或分子間的有效作用距離。
在涉及液體的表面張力是怎樣產(chǎn)生的問題時,有些專著和物理化學(xué)教科書是將表面張力與液體的內(nèi)壓力相聯(lián)系,闡明兩者的區(qū)別以及它們之間的密切關(guān)系。這對理解液體表面張力的來源有重要的意義。本文試圖進(jìn)一步從定量角度來闡明這個問題,并從中引出有價值的信息。
1、表面張力與內(nèi)壓力
若有一純物質(zhì)液體與其氣相共存,不難理解,液體體相中的分子與表面層分子的受力狀況是不相同的。體相中的分子受周圍分子的作用力是各向均等的,分子猶如在一個均勻的力場中自由地運動;而表面層中的分子受周圍分子的作用則是各向不均等的。由于通常氣相的密度遠(yuǎn)低于液相,致使表面層分子的受力是不對稱的,它們會受到垂直于表面且方向指向液體體相的合力的作用,這個合力來自液體分子間的作用,單位面積的這個作用力便稱為內(nèi)壓力。
表面層中的分子正是由于受到內(nèi)壓力的作用,使它們產(chǎn)生一種避離表面的傾向。于是,在可能的情況下,液體將盡可能地縮小其表面積。這種傾向猶如表面有一層繃緊的薄膜,使其受到一種收縮張力的作用,表面上單位長度的收縮張力便稱為表面張力或界面張力。
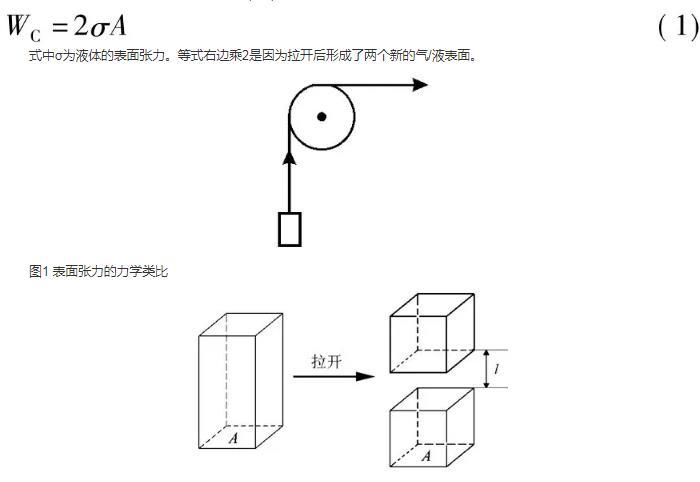
由此可見,表面張力與內(nèi)壓力是兩個不同概念的力,前者作用于表面,力的作用方向與表面相切,其作用是使表面盡可能縮小;而后者則源于分子間作用力的合力,其作用方向垂直于表面且指向液體的體相。這兩種力密切相關(guān),實為因果關(guān)系。有些專著用圖1所示的力學(xué)類比來形象地表示兩者間的關(guān)系猶如用滑輪舉起重物,舉重所做的功即為水平方向拉力所做的功,意即擴大液體表面積所增大的表面自由能等于液體從體相反抗內(nèi)壓力移至表面需做之功。本文試圖更進(jìn)一步在兩者之間建立定量關(guān)系。
2兩種力間的定量關(guān)系
設(shè)想有一柱狀液體,將它拉開分成兩半(圖2)。若液體的橫截面積為A,則不難得到拉開時需做之功為:
式(1)意味著拉開液體所做之功被完全用來增加液體的表面自由能,此功亦稱內(nèi)聚功,因為它是將原本內(nèi)聚在一起的液體拉開分成兩半需做的可逆功。顯然,這個功是因反抗液體的內(nèi)聚力亦即分子間的作用力所致。假定分子間的作用合力為F,分子間的有效作用距離為l,則內(nèi)聚功也可表示為:

式中pi=(?U/?V)T是內(nèi)壓力的熱力學(xué)定義,式(5)便是本文所得結(jié)果。由此可見,表面張力與內(nèi)壓力的關(guān)系是很簡單的,它不僅說明了縱向作用的內(nèi)壓力與表面上橫向作用的表面張力成正比,而且還能說明圖1所示的力學(xué)類比。圖3是該說明的示意圖。
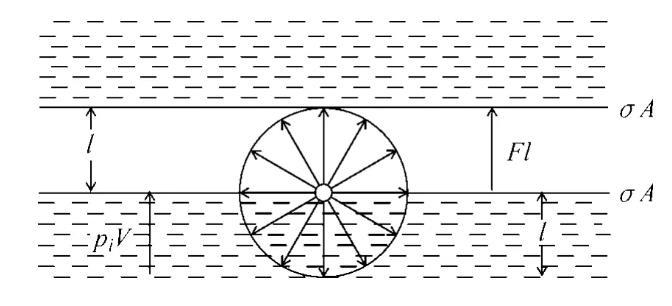
圖3力學(xué)類比說明示意
圖3只表示了氣/液表面上一個分子的有效作用范圍,它是一個半徑為l的圓球。圖中piV是體積為V的液體從體相反抗內(nèi)壓力移至表面時需做的可逆功;Fl是將液體拉開而分成兩半需做的可逆功,即上面所述的內(nèi)聚功WC。不難證明,這兩個可逆功是等價的,因為如式(4)所示,pi=F/A,而V=Al,其中V是體相中高度為l的液柱體積,A是液柱的橫截面積,所以有:
將式(6)代入式(3),可得:

式(7)實際上就是式(5)。這就是說,將體積為V的液體從體相反抗內(nèi)壓力移至表面需做的可逆功與將液體分成兩半需做的可逆功等價,都等于表面自由能2σA。
3液體表面層厚度
所謂表面層厚度,是指液體中分子受力不對稱區(qū)的厚度。不難明白,這個厚度正好等于液體分子間的有效作用距離l。因為任何與液面的距離小于l的液體分子都有可能與氣相分子發(fā)生作用,從而使它失去作用力的對稱性。現(xiàn)若用δ表示液體表面層的厚度,則因δ=l,式(5)也可表示為:

式(8)提供了一個估算難以測定的液體表面層厚度的簡便方法,因為液體的表面張力和內(nèi)壓力都可用實驗精確地測定。
表1是用此法算得的結(jié)果。表中列出了293.15K時若干非極性或弱極性液體的表面張力和內(nèi)壓力實驗值,由式(8)算得的液體表面層厚度δ則列在表1的最后一列。
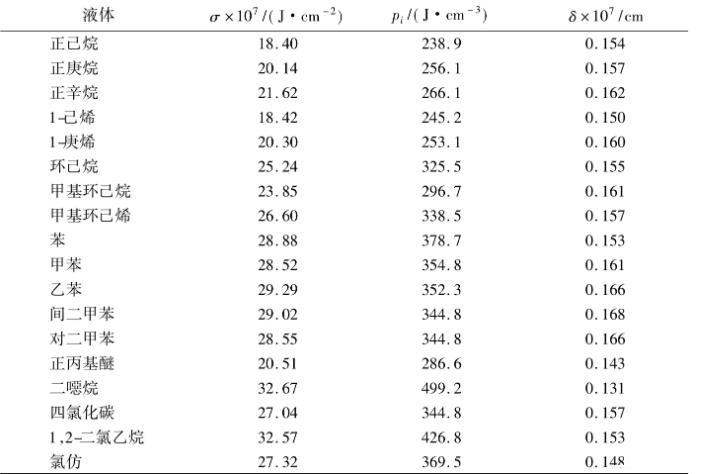
表1 293.15K時若干液體的表面張力、內(nèi)壓力和表面層厚度
由表1可見,這些液體的表面層厚度相差不大,約為1.5×10-8cm。這是由于這些液體的分子間作用力主要是van derWaals引力,這種力與分子間距的7次方成反比,故分子間的有效作用距離是很短的。這決定了液體表面層的厚度很小,在離開液面大約1個到幾個分子直徑距離后,分子的受力便各向均等而變?yōu)閷ΨQ了。
4討論
應(yīng)該指出,式(8)僅適用于非極性或弱極性液體。這是因為上述推導(dǎo)認(rèn)為,液體的表面自由能是由反抗液體分子間的內(nèi)聚力做功所致,如果將液體分成兩半,與環(huán)境沒有熱量交換,則液體的表面自由能完全是由內(nèi)聚能轉(zhuǎn)變而來,即:
式中-U為液體的內(nèi)聚能。由于非極性或弱極性液體分子間的作用力主要是van derWaals引力,其內(nèi)壓力可由a/V2表示,故有:
將式(10)代入式(9)即得式(7),其中V=Al。這就是說,將圖2所示柱狀液體拉開至分子間的有效作用距離l,就相當(dāng)于將體積為A×l的柱狀液體的內(nèi)聚能轉(zhuǎn)變成了液體的表面自由能,而這種液體則是非極性或弱極性的。
此外,式(8)計算是在氣相密度遠(yuǎn)低于液相密度,以致前者相比于后者可以忽略的情況下得到的,這就是說,表1計算結(jié)果僅適用于氣液兩相遠(yuǎn)離臨界狀態(tài)的情況。










